

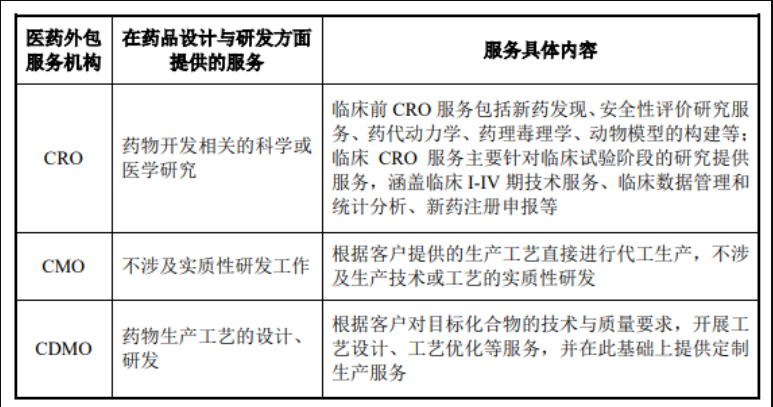
CDMO企业与CMO、CRO企业在药品设计与研发方面的差异:近年来,全球医药行业的竞争日趋激烈,制药产业链中的分工日益细化,医药行业的专业化外包已成为制药企业的重要战略选择。随着医药外包服务机构专业化程度的不断提高, 医药外包服务的内容逐渐涵盖了从疾病目标研究、药物化合物筛选、临床试验服务、工艺研发、规模化生产

发布单位国家市场监督管理总局发布文号国家市场监督管理总局令第100号发布日期2025-03-26生效日期2027-03-16有效性状态废止日期暂无属性规章专业属性标签标识第一章总则第一条 为了规范食品标识标注,加强食品标识监督管理,保护消费者合法权益,根据《中华人民共和国食品安全法》《中华人民共和国食品安全法实施条

对于药物分析的工作人员来说,检验方法的验证和确认步骤是必须了解的知识。本文对检验方法的验证和确认步骤及详细计算方法进行整理,供各位同仁学习参考。一、检验方法验证的基本内容检验方法验证的基本内容包括方案的起草及审批,检测仪器的确认。适用性验证(包括准确度试验、精密度测定、线性范围试验

一、概述辅料一般被看作是惰性物质,但是当辅料被添加到制剂中时,某些辅料可能会对药物的最终药理学作用产生非常大的影响。药物和辅料之间的相互作用可能是物理化学作用,也可能是生理作用,对制剂的稳定性、安全性和有效性均有一定程度的影响。其相互作用大小与药物的性质、辅料的性质及其加入量均有较大的关系,其相互作

1、柱容量柱容量越大越不容易过载。决定柱容量的指标是柱截面上固定相的面积占比,它与空容、填料的比表面积、表面健合率等色谱参数有关。需要注意的是,增加柱长并不能增加柱容量,因为样品进样后不可能立即分布于整个色谱柱,同样因为无限直径效应的缘故,增大柱内径也不能增大柱容量。2、进样量显然,减小进样量可

作为学有机化学的,在平时工作实验中,最最不可缺少的就是TLC点板跟踪反应,而显色剂的种类大家都知道有多少种?好的显色剂不但能够让你工作更加效率,更多的有可能帮助你减少失误。那么今天,这一篇,笔者罗列了几乎所有常用的显色剂,希望能够帮助到大家。注:TLC在浸润以下显色剂后,都一般需要热烤才能显色!4-甲

薄层色谱(Thin-Layer Chromatography: TLC)是在玻璃板上,塑料片或者铝箔覆盖有很薄的一层吸附剂的一种用于分离混合物的色谱法。薄层板展开的方法是其中一端被溶剂浸润后,溶剂在吸附剂的间隙中扩散,溶剂往上方移动进行爬板(毛细管现象)。如果在板子上点样混合物的话,那么化合物也会随着溶剂的移动而移动。这个时候,
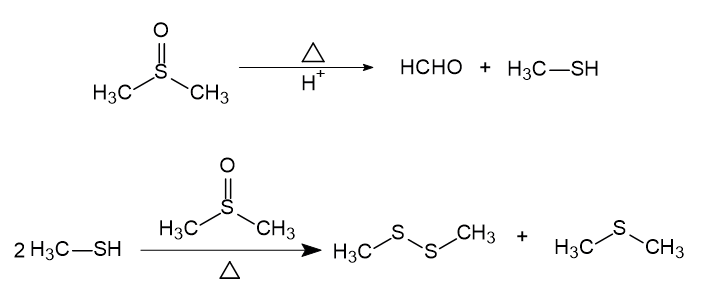
DMSO在酸性条件下,顶空加热至80℃以上易分解为甲硫醚、二甲基二硫醚和甲硫醇。建立盐酸盐类原料药的残留溶剂检测方法时,选用顶空进样方法测定时应避免使用二甲基亚砜(DMSO)做稀释剂,可选用水、N,N-二甲基甲酰胺等做稀释剂,可有效避免引入杂质峰干扰测定。◆DMSO在酸性条件下加热的反应机理方法建立背景我公司在

《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》[1]中明确提出注射剂需开展包装材料和容器的相容性研究。同时公众对药品的安全意识也在不断加强,对由包装系统引发的安全性问题关注度也日益增加,各国也出台了相应的法律法规及指导原则。《化学药物注射剂与塑料包装材料相容性研究技术指导原则(试行)》[

ICH Q7A 对于原料药(Active Pharmaceutical Ingredient, API)的定义:任何旨在供生产一种药物制剂,并作为其活性成分的物质或混合物,这类物质旨在疾病的诊断、治疗、缓减、处置和预防及影响人体的结构和功能等方面发挥药理作用或其他的直接效益。01原料药控制策略-有机杂质根据原料药的合成工艺

分析方法在药学质量研究中扮演重要的角色,普析手段目前还是在分析领域占据重要的位置,一般尤以HPLC-UV占比最大,一个好的分析方法能有效检出样品中存在的所有杂质,不遗漏某些杂质的检出,以免误导工艺人员正确的开发。 分析方法的建立往往在原
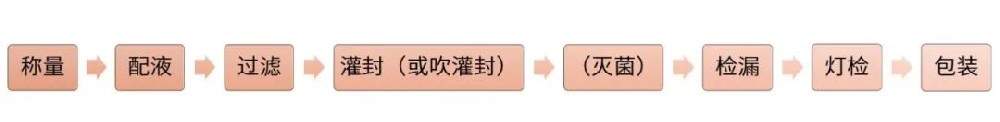
滴眼剂系指由原料药物与适宜辅料制成的供滴入眼内的无菌液体制剂,其生产和质量要求一般参考注射剂的技术要求。本文结合《化学药品注射剂仿制药质量和疗效一致性评价技术要求》等相关要求,具体阐述滴眼液研究过程中的研发内容及注意事项。参比制剂信息确认参比制剂来源确

根据国家相关法律法规要求,药品上市许可持有人(申请人)应当主动开展药品上市后研究,实现药品全生命周期管理。鼓励持有人运用新生产技术、新方法、新设备、新科技成果,不断改进和优化生产工艺,持续提高药品质量,提升药品安全性、有效性和质量可控性。但药品上市后变更不得对药品的安全性、有效性和质量可控性产生不良

核心研究“四维框架”:全面评估变更影响安全性(Safety):确保包材自身无害,不引入新风险;保护性(Protectiveness):验证包材能否有效保护药品;功能性(Functionality):考察包材是否适用、易用;相容性(Compatibility):研究药品与包材的相互作用;变更研究的“落地执行”:等同性/可替代性评价与申报综合评估与等

在处理血浆或组织样本时,你是否遇到过这种怪事:标准曲线做得完美无缺,但到了真实样本,内标响应却开始乱跳,甚至出现目标物信号被莫名“吃掉”的情况?其实,幕后真凶往往就是那些在蛋白沉淀过程中“漏网”的——磷脂(Phospholipids)。一、 为什么是磷脂?磷脂是生物样本中含量极高的内源性组分。它们在电喷雾电离(ES

前言:在进行 LC-MS/MS 高灵敏度方法开发(如 pg/mL 级别)时,可能最让人头疼的不是灵敏度不够,而是残留(Carryover)。 你是否遇到过:进完最高浓度的标准曲线,连进三个随行双空白( D Blank),结果空白里目标物的峰依然“阴魂不散”,甚至超过了 LLOQ 的 20%?当然,这个时候,你可以先找到下文进行排查:如果找到了洗

选择电喷雾电离(Electrospray Ionization, ESI)或大气压化学电离(Atmospheric Pressure Chemical Ionization, APCI)取决于分析物的特性和实验需求。 1.@@@ 分析物的极性 APCI:适用于中等极性到非极性化合物,如小分子有机物、类固醇、脂类、挥发性有机化合物等。APCI

前言: 做生物分析,最怕“红红的”。面对溶血样本,你是硬着头皮做,还是直接标记弃用?(最好是拒收啊)。溶血对液质分析的影响,远不止增加基质复杂度那么简单。今天,我们聊聊溶血背后那些看不见的“数据杀手”。)))————————————1. 痛点:为什么溶血是质谱方法的死穴?有这样的切实感受,在看审稿人问题

前言:在进行 LC-MS/MS 高灵敏度方法开发(如 pg/mL 级别)时,可能最让人头疼的不是灵敏度不够,而是残留(Carryover)。 你是否遇到过:进完最高浓度的标准曲线,连进三个随行双空白( D Blank),结果空白里目标物的峰依然“阴魂不散”,甚至超过了 LLOQ 的 20%?当然,这个时候,你可以先找到下文进行排查:如果找到了洗

前言:在开发液质方法时,你是否遇到过这样的怪事:化合物明明带正电荷,但在酸性流动相里响应极低,甚至怎么加电压也顶不上去?或者峰形像个“老太太”,拖尾拖到天荒地老?作为大同行,我想告诉你:流动相添加剂不只是为了调节 pH,它更是一场关于“离子化效率”的生死博弈。一、 0.1% FA 不是万能钥匙我们默认使用 0.1%

前言:在生物分析实验室,最让人崩溃的瞬间,莫过于进样后看到满屏的峰分叉或峰展宽。你第一反应是不是:柱子塌陷了?还是进样针堵了? 先别急着下结论!今天我们要聊的,是一个极易被忽视、却在方法开发中极其高发的“隐形杀手”——溶剂效应(Solvent Effect)。现象描述:明明是纯标准品,为什么出了“双峰”?在进行大批

在生物分析的日常工作中,最让人崩溃的瞬间莫过于:在空白血浆样本中,竟然在待测物(Analyte)的出峰时间点,看到了一个形态完美的干扰峰(鬼)……。你检查了进样针污染,更换了色谱柱,甚至重配了流动相,但那个干扰峰依然如影随形。这时候,你可能遇到了液质定量中的“隐形杀手”——信号串扰(Cross-talk)。一、 什么

在液质分析中,我们常说“加点盐”能改善峰形、改善电离。但你真的分得清什么时候该用醋酸铵,什么时候该用甲酸铵吗?还是不管三七二十一,试了再说?选错缓冲盐,不仅会损失灵敏度,还可能让你的质谱图布满“杂质丛林”1. 痛点:为什么“加盐”反而没信号了?在开发碱性药物(大多药物为碱性)的方法时,你是否遇到过:灵敏

根据药品注册的国际技术要求(ICH)中杂质的含义, 杂质分为有机杂质、无机杂质和残留溶剂。有关物质是杂质的一种, 主要是指有机杂质。它的检查方法很多, 而其中的HPLC法具有专属性强、分离效果好、灵敏度高、分析速度快、重复性好、操作简便等诸多优点, 且能与多种类型检测器联合应用, 能满足大多数化合物种类的检测需要, 比较

国家药品监督管理局药品审评中心《化学仿制药药学研究重大缺陷(试行)(征求意见稿)》(2025年12月3日发布)中要求:不同申请的申报资料共用研究数据(包括但不限于原辅包研究、处方开发、工艺开发、工艺验证、质量研究、对照品研究、相容性研究、稳定性研究等的研究数据)的,包括新申报的药品与已批准药品共用研究数据的