


目前药行的小伙伴们接触较多的剂型是以片剂、胶囊剂、针剂居多。但是,对于像糖浆剂、贴膜剂,喷雾剂,软膏剂、栓剂却不是很常见。今天我们就换换方向,聊一聊大家见得不多的剂型——软胶囊(胶丸)。随着软胶囊应用越来越广泛,软胶囊开始被争相研发、仿制。软胶囊参比制剂的逆向解析工作也就成为了软胶囊研发至关重
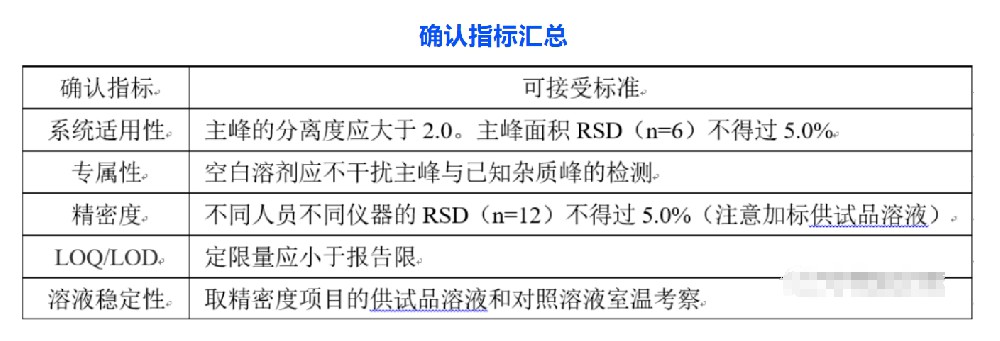
制剂通常的发补内容格式:参照各国药典,结合所用原料药的合成路线,对可能存在的杂质进行全面分析,考察自拟有关物质检查方法对各已知杂质的分离和检出能力,必要时对有关物质方法进行优化,提供自拟方法的验证资料。尬点:原料药采用自拟方法(申报时药典没收载)虽然重新全面考察了已知杂质的分离度和检出限均满足要求,

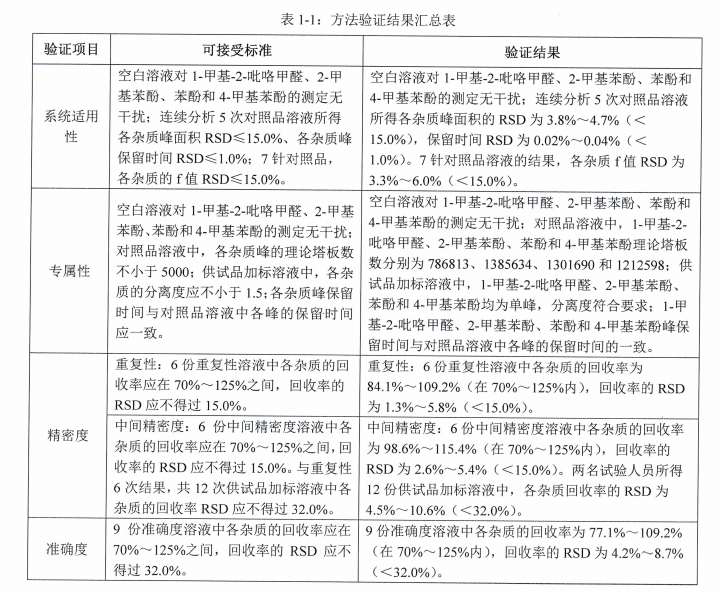
一、摘要本试验对XXXXXX有限公司提供的聚丙烯输液袋(含聚丙烯组合盖)进行相容性研究。参考《化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)》,选择合适的模拟溶剂(制剂溶液、pH3酸性提取液、pH10碱性提取液、15%乙醇溶液)和提取条件对聚丙烯输液袋(含聚丙烯组合盖)进行模拟提取试验,预测可能迁移到药

HPLC指纹图谱是一种使用高效液相色谱(HPLC)技术来获取样品(通常是中药材或中药制剂)的指纹图谱的方法。其基本原理是,不同样品在色谱柱上的分离效果不同,从而得到的色谱图也不同,这种色谱图可以用来标识样品的化学特征和组成。HPLC指纹图谱的用途主要有以下几个方面: 质量控制:通过比较样品的HPLC指纹

“分析方法通则”类标准特指未指定检测对象或只是指定了某一类检测对象的仪器设备分析方法通则。如:JY/T016-1996《波长色散型X射线荧光光谱方法通则》GB/T 15337-2008《原子吸收光谱分析法通则》JIS K0127-2001《离子色谱分析方法通则》那么,通则类标准可以申请CNAS和CMA认可吗?情况1对某检测对象使用特定仪器法检测时,
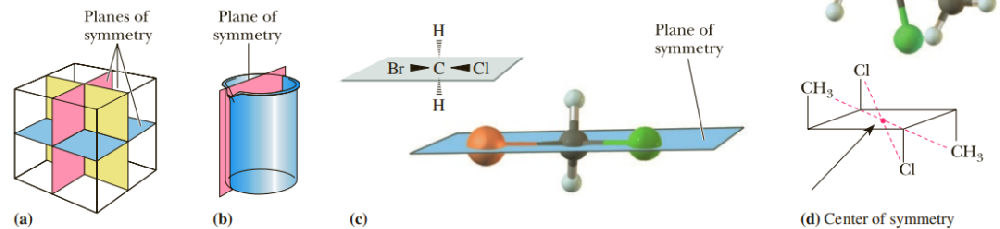
| 手性碳原子与手性分子一种物质不能与其镜像重合的特征称称为手性,具有这种特征的分子称为手性分子,手性分子都具有旋光性。一般可通过判断分子的对称因素来确定其是否具有手性:具有对称面、对称中心或旋转反射轴的任一对称因素的分子均为非手性分子,反之则为手性分子。与四个不同基团相连的碳原子称为不对称碳原子或手

一、概念解析醛、酮分子中由于羰基的影响,α-H变得活泼,具有酸性,所以带有α-H的醛、酮具有互变异构的性质。在溶液中有α-H的醛、酮是以酮式和烯醇式互变平衡而存在的。如下图所示:有两类结构式在药物领域非常常见: 1)β-二羰基化合物,如乙酰丙酮及其衍生物,由于其具有活泼的α-H,经常出现在药物

1化学药物进行结构确证的一般顺序 单一组分化合物通常是定向合成、天然产物提取、发酵提取或半制备等方式制备得到,通过液相或气相等检测手段评估纯度(原料药纯度通常≥99.0%;杂质纯度通常≥90.0%)后,主要通过核磁共振氢谱(1H-NMR)、光谱及常规质谱(MS)等方法,基于合成机理推断平面结构;如合

1、强制试验强力试验Stress Testing,又称为强力破坏试验,或强制降解试验,为原料药和产品设计符合监管要求的稳定性计划的重要步骤,该类试验有助于确定可能的降解产物,而这些降解产物又可帮助了解降解途径和分子内在的稳定性,并论证使用的分析方法是否能反映产品的稳定性。强制破坏试验的类型将取决于各种原料药的性质及
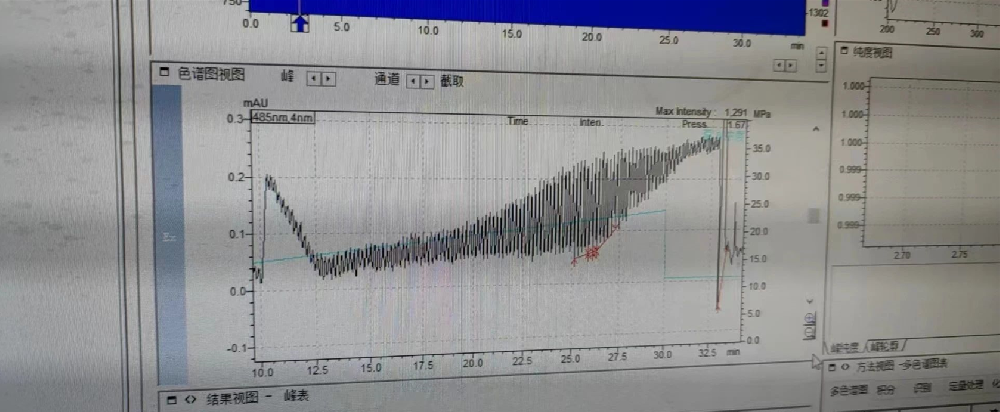
由气泡引起的比较微弱的锯齿状波动(小于1mAu),所有每次做样要做好排气泡。压力问题总结压力过大1. 泵后的某个环节堵塞,如在线过滤器、色谱柱、进样针、检测器、六通阀都会导致柱2. 色谱条件错误,色谱柱、流速、温度、pH等等压力过小1. 泄露,各个接头泄露或者管路破损2. 色谱条件错误,色谱柱、流速、温度、pH等等3.单
1、中国专利公布公告网网址:http://epub.sipo.gov.cn/简介:网站包括自1985年9月10日以来公布公告的全部中国专利信息,其检索功能可以按照发明公布、发明授权、实用新型和外观设计四种公布公告数据进行查询,数据主要包括中国专利公布公告信息,以及实质审查生效、专利权终止、专利权转移、著录事项变更等事务数据信息。2、
打开浏览器,输入“FDA”进入或打开链接https://www.fda.gov/,进入FDA主页,如“图1”图1点击“图1”中“Drugs”进入药物检索页,网址:https://www.fda.gov/drugs,一般情况从“图2”中“Drug Approvals and Databases”可获取绝大多数FDA公开的原研药品信息。图2点击“图2”中的“Drug Approvals and Databases”进入药物

一提起药品说明书,大家肯定会说它是用来指导患者安全用药的东西,和药品研发似乎关系不大。当我们不知道药品的用法用量,才会看看说明书上是怎么写的。其实,大家对于药品说明书的了解不应该仅此而已。对于药研人来说,作为药品的“身份证”,药品说明书提供了很多药品安全性、有效性的重要科

根据药品注册的国际技术要求(ICH)中杂质的含义, 杂质分为有机杂质、无机杂质和残留溶剂。有关物质是杂质的一种, 主要是指有机杂质。它的检查方法很多, 而其中的HPLC法具有专属性强、分离效果好、灵敏度高、分析速度快、重复性好、操作简便等诸多优点, 且能与多种类型检测器联合应用, 能满足大多数化合物种类的检测需要, 比较
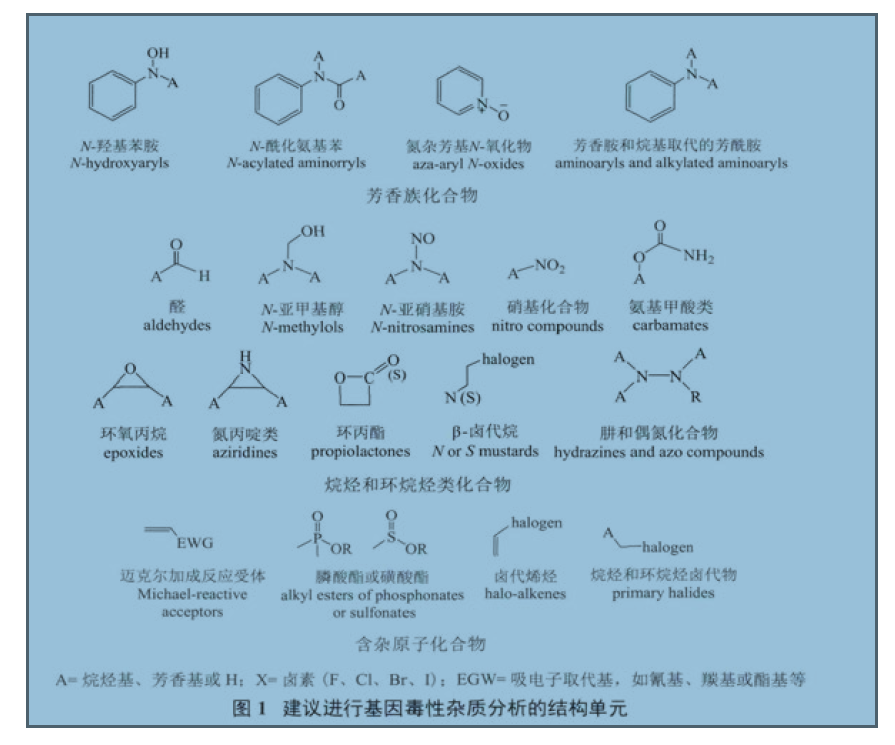
1 从宏观上解读杂质1.1 杂质与药物不良反应的关系 很多同仁都认为杂质与药物的不良反应息息相关,认为杂质越小或越少、临床不良反应发生几率也就越小或越少,进而在进行杂质研究与控制时,力求面面俱到、尽善尽美。殊不知,引起药物不良反应的原因是多方面的,并不仅仅是药物中的杂质。人用药品注册技术要求国

体外释放试验(in vitro release test,IVRT)是表征和评价半固体制剂性能的有效手段,体外释放速率可以反映药物的溶解度、粒径、剂型流变性等多种理化参数的综合作用,可辨别处方和工艺变化对制剂的影响,是产品开发、质量控制、稳定性考察及产品批准后变更的重要质量控制项目。&nbs
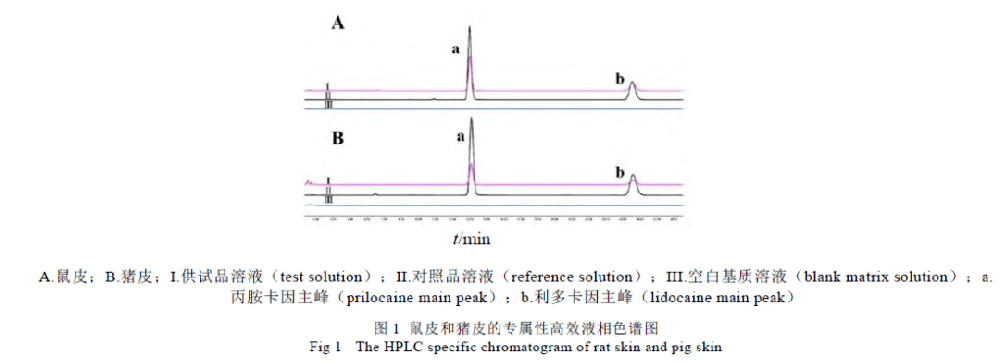
目的:综合国内外关于半固体制剂的体外药物释放试验的研究,探讨关于体外药物释放试验各装置特点及试验条件的选择并判断释药模型。方法:根据国内外31篇文献,对如何根据所研究半固体制剂的特点选择合适装置及试验条件进行体外药物释放试验进行综述。结果:通过药物的体外释放结果判断出药物符合的释药模型并阐明释药机理。
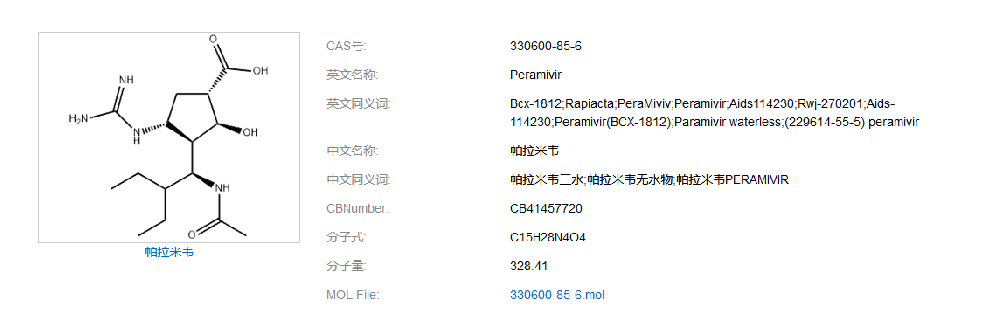
如何建立帕拉米韦质量标准,现在百度检索:同时在药物在线(https://www.drugfuture.com/standard/):各国药典均未收录载帕拉米韦。无药典收载、无进口标准:医学百科(https://www.yixue.com):帕拉米韦水合物是美国BioCryst 公司开发的以流感病毒表面糖蛋白神经氨酸酶为作用靶点的新型环戊烷类抗流感病毒制剂,是世界首

变更相关问题问题1:附条件批准上市药品在二期沟通时,提出在上市申请审评期间做生产厂地的变更,请问是否可行?答:首先我们不建议在上市审评期间做生产厂地变更。不管是一类药、二类药、三类药还是四类药,确实在审评期间有一个提交变更的通道,但根据《药品注册管理办法》,审评期间发生重大变更时,上市申请是要撤

NO 1:裂峰判定思路01):是否没分开:峰形异常可能由多种因素引起,且某些情况可通过简单调整得以解决,但根本原因仍需明确识别。首要任务是判断观察到的是否为单个变形峰(可能源于装填问题或床层完整性受损),或是两个未完全分离的化合物共存。02):经验法则:若仅有一个峰出现分裂,则问题更可能与方法条件或化学因素相

NO 1:方法开发的"标准流程"与"隐藏杀机 正确姿势:用SciFinder、PubMed搜目标物+ "LC-MS/MS method development",重点关注: 质谱参数(ESI/APCI选择、离子对优化)

酸奶和乳酸(菌)饮料在营养上各有侧重点。购买时应认真查看配料表中的成分和产品储存条件,避免被花哨的外包装所误导。近日,有报道称市场上出现了一种“假酸奶”现象:这些看似酸奶的饮品,实则只是披着健康外衣的高糖“小甜水”。从酸奶、酸乳、发酵乳到优酪乳、风味酸奶、风味发酵乳……琳琅满目的名称让消费者眼花缭乱

2025年9月实施的食品相关标准,涵盖消毒剂、食品微生物学检验、食品添加剂、食品营养强化剂、食品接触材料及制品等多领域。2025年9月实施的食品相关标准,由食品伙伴网根据国家卫生健康委员会 国家市场监督管理总局关于发布《食品安全国家标准 预包装食品标签通则》(GB 7718-2025)等50项食品安全国家标准和9

药品中亚硝胺的潜在风险始终是全球医药行业关注的焦点。我们在开展药品亚硝胺风险的评估时,往往关注于原料的引入情况以及制剂的降解,而对于辅料的影响却关注不足。其实,辅料对亚硝胺形成的潜在影响不容忽视。尽管辅料直接引入亚硝胺的风险极低,但其所含的特定反应性物质(如亚硝化剂或胺类成分)可能间接促进或抑制亚硝