


参考头孢地尼胶囊的说明书,每日最大用量为0.3g,根据FDA发布的《人用药中亚硝胺杂质控制》行业指南,NDMA和NDEA每日可接受摄入量分别为:96.0ng/天和26.5ng/天,计算N-亚硝基二甲胺(NDMA)限度为:96ng/day÷0.3g/day=320ppb,N-亚硝基二乙胺(NDEA)限度为:26.5ng/day÷0.3g/day=88ppb。根据上述限度要求,并参考《中国

1.酰胺类亚硝酸盐的致突变机制由上述致突变机制可知,普通亚硝胺类杂质通过CytP450酶作用,形成活性碳正离子,酰胺类主要通过重排形成。亚硝胺在体内产生毒性的作用机制(需代谢活化)与N-亚硝基脲(直接产生重氮化物或R自由基)不同,部分亚硝基化合物的毒性机制还没有确切结论,此外基于亚硝胺类化合物在药品

让我们深入了解这 17 种毒性试剂 ,以便在实验室操作中更好地保护自己和他人的安全。DMSO(二甲基亚砜):一种用途广泛的非质子极性溶剂,可溶解乙炔、芳烃、二氧化硫等气体,也常用于腈纶纤维纺丝。它能溶于水和有机溶剂,对皮肤有强渗透性,可用于药物透皮吸收和农药添加剂,还可作为细胞保护剂,降低细胞冰点,减少冰晶形

1. 查找FDA已批准的药物信息:Drugs@FDAFDA已批准的药物信息:最新药品说明书评审资料,了解原研药CMC、非临床、临床等信息查找某药在美国已获批的剂型、规格和给药方式链接:http://www.accessdata.fda.gov/scripts/cder/daf/index.cfm2. FDA橙皮书数据库:Orange BookFDA经治疗等BE批准的药品(通常称为橙皮书)收录已经被

一、杂质的定义在原料药中化学结构与原料药不同的任何一种成分都称为杂质。杂质分为有机杂质、无机杂质和残留溶剂。有机杂质的指导原则有ICH Q3A(原料药)、ICH Q3B(制剂)、ICH M7(致突变杂质),无机杂质中元素杂质的指导原则为ICH Q3D,残留溶剂的指导原则为ICH Q3C.二、有机杂质定义定义分类:有机杂质可能会在

1.引言化学表征是评估医疗设备使用中潜在患者安全风险的生物相容性评估过程中的一个关键步骤(见图1)。图 1. 生物评估流程,突出显示化学表征的关键步骤。通过分析医疗设备的原材料、制造过程、包装和灭菌过程的表面化学分析或可提取物和可浸出物(E&L)分析,可以实现化学表征。E&L分析是按照ISO 109

致突变杂质或者致癌性杂质如何分类?有警示结构的杂质就一定是致癌性或者致突变杂质吗?没有警示结构的杂质就不是致癌性或者致突变杂质吗?遗传毒性杂质和致突变杂质有什么区别?致突变非致癌杂质属于那一类?致癌性非致突变杂质属于那一类?细读上述分类,随着毒性杂质的研究,一些分类的细节问题随之暴露,例如:有致突变

01什么是有关物质?有关物质的英文是related substance,related意为相关的、有亲戚关系的、同族的。由此我们可以看出,有关物质是与药物主成分结构存在渊源关系的杂质,包括用于直接或间接形成目标物质结构的物质(起始物料、中间体),或是同步反应的其他产物(副反应产物、异构体),或是主成分的衍生产物如降解杂

有关物质泛指在药品的生产与储存过程中产生的工艺杂质或降解产物。一个经过严格验证的方法才能更有效地控制产品的纯度,进而降低毒副作用的产生。我们对有关物质的控制方法一般为面积归一化法、加校正因子的自身对照法和外标法。《中国药典》2020年版,在《药品质量标准分析方法验证指导原则》中新增了对校正因子的验

关于分析方法验证线性考察是定量分析的基础和必要条件,定量是基于呈一元一次方程的线性关系进行的,除了需要考察相关系数以确定是否成线性,还必须考察回归方程的截距问题,通常使用两种方法,一种为Y轴截距绝对值与标准(100%)之比法,另一种为剩余标准差标准(100%)之比法,二种方法均能反应截距的大小,对于含量应该不

给实验动物用药需要仔细考虑和计划,以优化给动物的药剂递送,同时最大限度地减少手术中的潜在不良反应。对于所有物种,都有许多不同的物质给药途径。必须考虑给药量、给药部位、物质的pH值和其他因素,以完善该技术。在研究的这一方面,训练不足或不注意细节可能会对实验动物产生无意的不良影响,并导致结果混乱。给实验动

仿制药是指与原研药剂量、安全性和效力(strength)(不管如何服用)、质量、作用(performance)以及适应症(intended use)上相同的一种仿制品。原研药专利到期以后,其他国家和制药厂即可生产仿制药。那么作为药研人员应该根据仿制的对象,搜集整理那些信息内容呢?又该怎么查询这些信息呢?

化学分析网记得在学校的时候,一般合成的化合物,先点板(TLC)监测反应,有产物生成后,再过柱子,打核磁,质谱会最后做。随着技术的不断发展和高校科研条件的不断改善,越来越多的科研机构和制药公司都配备了LCMS,既可以用来监测反应,又可以用来表征产物的纯度。小编发现,现在大家越来越依靠LCMS

氨基酸有D型和L型氨基酸,天然氨基酸为L型的氨基酸。在多肽类药物固相合同过程,固相合成过程可能导致氨基酸的消旋,产生了D型的氨基酸插入到多肽药物中,影响药物的空间构型。此外,带保护的氨基酸也可能在合成过程发生构型的变化,引入了D型的带保护的氨基酸,因此,差向肽的控制成为一个不可逾越的话题。作为合成多肽有关

下图红框的已知杂质峰形较差从峰形上判断:1、可能是溶剂效应;2、也有可能是结构互变;以及按碱或高温改善羰基类的马鞍峰或前沿峰一文,升高柱温没有改善。如上述操作没有改善,再看一下杂质结构为一对映异构体,见下图,峰形差可能是这一对映异构体在反相中没有完全重叠,也即C18可以识别这组对映异构体。使用数据库hplcc

1.前言现在大家一致认为分子的手性是生命过程中必不可少的部分,还一致同意大多数控制活生物体生理机能的生物活性化合物都是具有手性的。因而,在针对生物活性化合物以及天然产物的结构研究上,其绝对构型的测定成为首要的重大问题。其次是成为医药目标的生物活性化合物和天然产物的手性合成,以及如何有效的利用100%对映体

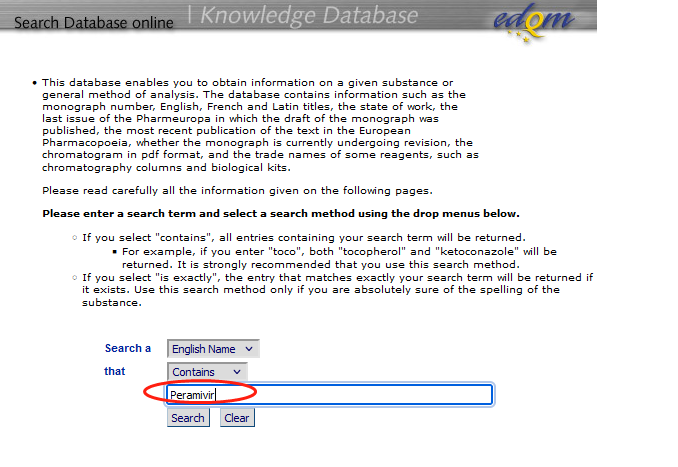
分析方法如果能直接引用药典则是最省事的。已说明每种C18色谱柱都不完全相同。药典方法无法重现的多数原因是没有正确选择色谱柱,EP和USP的个论中虽然没有提供色谱柱的品牌信息,但是在官网上提供了色谱柱的品牌信息。1、EP色谱柱检索链接https://www.edqm.eu/en/knowledge-database点击SearchKnowledge Databa

我们知道了FDA、EMA和PDMA,澳大利亚也有原研审评报告。那么澳大利亚的原研审评报告无法下载,以下是正确的打开方式:方法一澳大利亚官网https://www.tga.gov.au/选择下图红框菜单选择Industry » Prescription medicines »Regulatory decisions and notices进入以下界面,选择Australian Public Assess

原料药工艺相关问题 问题1:想问一个关于起始物料的问题,这个药是一个化学药,正在做I期临床,它的起始物料是一个全合成的多肽。考虑到这个生产成本,想在三期临床前把起始物料改成发酵工艺。按照ICH Q11的指南及杂质研究的原则,我们还需要考虑哪些问题? 答:如果是全合成改为基因工程的工艺,那

另一个路径也相伴相生,付费且保持更新的软件,从客户易用性+可感知的高效、高值,似乎总是更胜一筹。本文主要分享免费可用的软件,部分支持软件再编程。01:SageSage 是一个极其快速的开源蛋白质组学搜索引擎,用于光谱匹配和定量分析。它在文中作为现代高性能 OSS 的代表被提及,能够处理大规模数据集并支持云原生工作流。

EMA于2025.08.01更新了亚硝胺杂质的相关内容(Rev. 10),较前一版本(Rev. 9),本次新增14种N-亚硝胺类杂质,与FDA公布的亚硝胺杂质清单形成互补——有部分双方共有的杂质,也新增了部分 FDA 尚未纳入的新杂质,进一步完善了亚硝胺类杂质的监管覆盖范围。例如,EMA 此次新增的 N - 亚硝基-贝罗司他(N-nitroso-berotralst

药物合成工艺路线中,所有潜在杂质和实际存在的杂质,包括原料、起始物料、中间体、试剂、催化剂、溶剂、副产物、降解产物,以及可能存在的潜在杂质,例如磺酸和醇类反应的杂质,位置异构体等。切记:路线设计和试剂筛选时,要考虑到可能产生的致突变性或致癌性杂质。评估方式毒性杂质评估方式一般包括:文献检索、QSAR评估
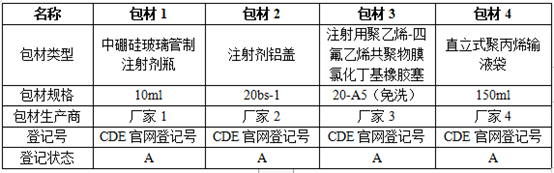
注射剂包装系统无质量风险是注射剂产品质量以及安全性合格的重要前提,那么这部分研究思路是怎样的,如何撰写申报资料以达到CDE审评要求呢?本文将对包装系统研究思路以及资料撰写思路进行讨论。包装系统研究主要有包装系统基本信息获取、包装系统的选择及匹配性、包材性能的对比以及包材相容性四个部分组成,由于篇幅有限本