


各种不同的分析、分离纯化和结构鉴定技术应用于药物研发的整体过程,其中对化合物的纯度确定是分析工作的重要内容之一。在新药研发过程中,许多待标定的化合物是新化合物,没有已知纯度的自身标准品。这时,需要经验丰富的分析人员对化合物进行各种不同的测试,主要包括HPLC纯度、有关物质、杂质、水分、残留溶剂、无机盐等
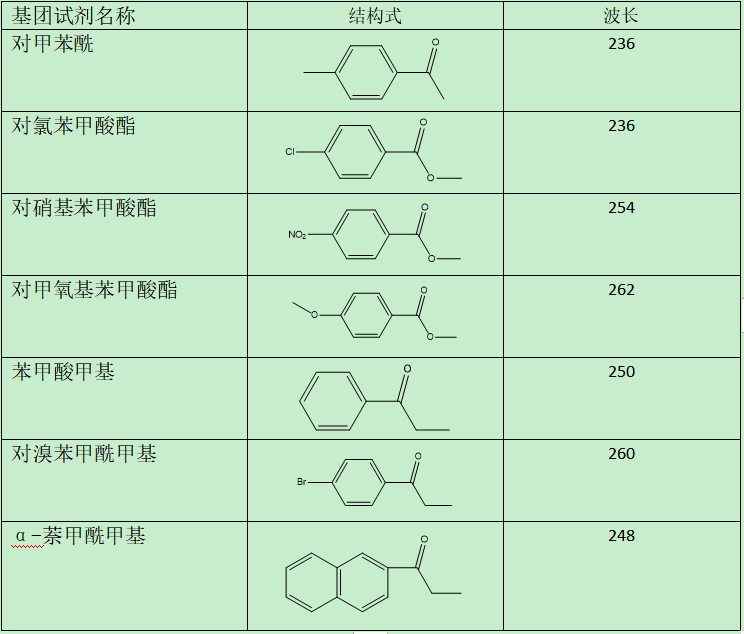
杂质没有紫外吸收怎么办? 传统化学方法,无法准确定量,怎么办? 示差检测器,蒸发光检测器,灵敏度低,满足不了检测限要求,怎么办? LC-MS,价格昂贵,适用范围窄,怎么办? 在整个药品研发过程中,产品杂质研究是至关重要的一环,一些特殊杂质

起始原料(Starting material)是构成API 结构的重要结构组成部分的一种原料、中间体或API。它可以是已上市的商品、以合同或商业协议方式购自一家或多家供应商的产品,或是企业自己生产的物质。根据国内外GMP要求,起始原料作为GMP监控的起点,需要接受国内外官方机构的监督检查。❖ 起始原料选择依据依据ICH Q

为证明所采用的分析方法是否适合于相应检测要求和目的,被测样品质量是否可控,保证得到一致、可靠和准确的测定结果,检测人员是否有能力操作分析方法,进行化学药品分析方法的验证、转移和确认。 方法验证(method validation)[概念]实验室通过试验设计和测试,对方法学
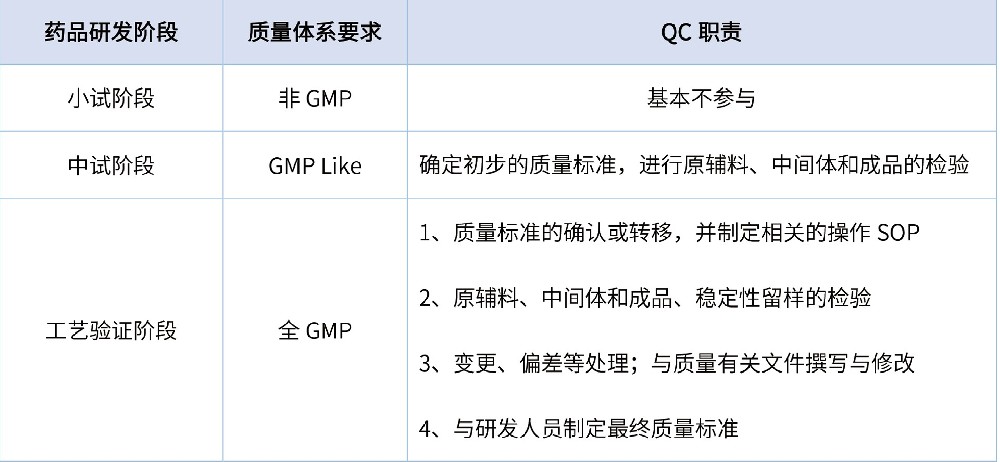
按照最新版《药品管理法》(2020版)要求,在药品全生命周期中需执行四个最严,即“最严谨的标准、最严格的监管、最严厉的处罚、最严肃的问责”。为保证药品的安全性和有效性,药品研发作为药品生命周期的源头,需在遵循《药品管理法》的前提下执行好《药品注册管理办法》法规要求。药品研发按创新药、改良型新药、仿制药进
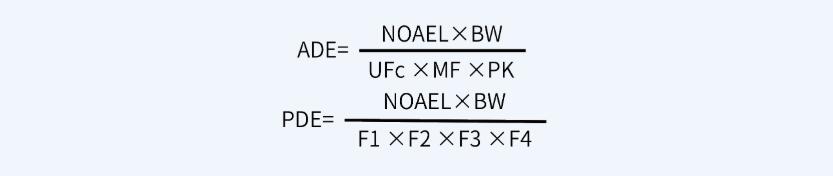
药品生产后必须对其生产设备采取一定的程序进行清洗,防止药物成分残留到下一批产品中,形成交叉污染,从而影响下一批产品的质量及安全性。清洁验证是证实清洗程序合理性的必要技术手段。WHO、EU、ICH、FDA及我国药品GMP均对药品生产清洁验证提出了相关要求:1)使用同一生
导读:近期CDE官网更新了:仿制药质量和疗效一致性评价百问百答(第3期),其中包括「杂质研究+溶出曲线对比」新规问:口服固体制剂一致性评价杂质研究需要注意哪些问题?答:口服固体一致性评价品种均为已上市品种,杂质研究中可以参考的文献资料较多,但是杂质研究不全面或过度研究,均可能给研发和审评带来不必要的负担,

对于药物分析的工作人员来说,检验方法的验证和确认步骤是必须了解的知识。本文对检验方法的验证和确认步骤及详细计算方法进行整理,供各位同仁学习参考。一、检验方法验证的基本内容检验方法验证的基本内容包括方案的起草及审批,检测仪器的确认。适用性验证(包括准确度试验、精密度测定、线性范围试验

一、概述辅料一般被看作是惰性物质,但是当辅料被添加到制剂中时,某些辅料可能会对药物的最终药理学作用产生非常大的影响。药物和辅料之间的相互作用可能是物理化学作用,也可能是生理作用,对制剂的稳定性、安全性和有效性均有一定程度的影响。其相互作用大小与药物的性质、辅料的性质及其加入量均有较大的关系,其相互作

1、柱容量柱容量越大越不容易过载。决定柱容量的指标是柱截面上固定相的面积占比,它与空容、填料的比表面积、表面健合率等色谱参数有关。需要注意的是,增加柱长并不能增加柱容量,因为样品进样后不可能立即分布于整个色谱柱,同样因为无限直径效应的缘故,增大柱内径也不能增大柱容量。2、进样量显然,减小进样量可
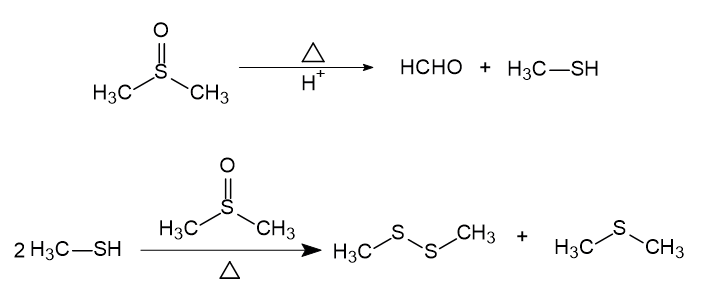
DMSO在酸性条件下,顶空加热至80℃以上易分解为甲硫醚、二甲基二硫醚和甲硫醇。建立盐酸盐类原料药的残留溶剂检测方法时,选用顶空进样方法测定时应避免使用二甲基亚砜(DMSO)做稀释剂,可选用水、N,N-二甲基甲酰胺等做稀释剂,可有效避免引入杂质峰干扰测定。◆DMSO在酸性条件下加热的反应机理方法建立背景我公司在

《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》[1]中明确提出注射剂需开展包装材料和容器的相容性研究。同时公众对药品的安全意识也在不断加强,对由包装系统引发的安全性问题关注度也日益增加,各国也出台了相应的法律法规及指导原则。《化学药物注射剂与塑料包装材料相容性研究技术指导原则(试行)》[

ICH Q7A 对于原料药(Active Pharmaceutical Ingredient, API)的定义:任何旨在供生产一种药物制剂,并作为其活性成分的物质或混合物,这类物质旨在疾病的诊断、治疗、缓减、处置和预防及影响人体的结构和功能等方面发挥药理作用或其他的直接效益。01原料药控制策略-有机杂质根据原料药的合成工艺

分析方法在药学质量研究中扮演重要的角色,普析手段目前还是在分析领域占据重要的位置,一般尤以HPLC-UV占比最大,一个好的分析方法能有效检出样品中存在的所有杂质,不遗漏某些杂质的检出,以免误导工艺人员正确的开发。 分析方法的建立往往在原
滴眼剂系指由原料药物与适宜辅料制成的供滴入眼内的无菌液体制剂,其生产和质量要求一般参考注射剂的技术要求。本文结合《化学药品注射剂仿制药质量和疗效一致性评价技术要求》等相关要求,具体阐述滴眼液研究过程中的研发内容及注意事项。参比制剂信息确认参比制剂来源确

根据国家相关法律法规要求,药品上市许可持有人(申请人)应当主动开展药品上市后研究,实现药品全生命周期管理。鼓励持有人运用新生产技术、新方法、新设备、新科技成果,不断改进和优化生产工艺,持续提高药品质量,提升药品安全性、有效性和质量可控性。但药品上市后变更不得对药品的安全性、有效性和质量可控性产生不良

仿制药是指与原研药剂量、安全性和效力(strength)(不管如何服用)、质量、作用(performance)以及适应症(intended use)上相同的一种仿制品。原研药专利到期以后,其他国家和制药厂即可生产仿制药。那么作为药研人员应该根据仿制的对象,搜集整理那些信息内容呢?又该怎么查询这些信息呢?

化学分析网记得在学校的时候,一般合成的化合物,先点板(TLC)监测反应,有产物生成后,再过柱子,打核磁,质谱会最后做。随着技术的不断发展和高校科研条件的不断改善,越来越多的科研机构和制药公司都配备了LCMS,既可以用来监测反应,又可以用来表征产物的纯度。小编发现,现在大家越来越依靠LCMS

1.前言现在大家一致认为分子的手性是生命过程中必不可少的部分,还一致同意大多数控制活生物体生理机能的生物活性化合物都是具有手性的。因而,在针对生物活性化合物以及天然产物的结构研究上,其绝对构型的测定成为首要的重大问题。其次是成为医药目标的生物活性化合物和天然产物的手性合成,以及如何有效的利用100%对映体

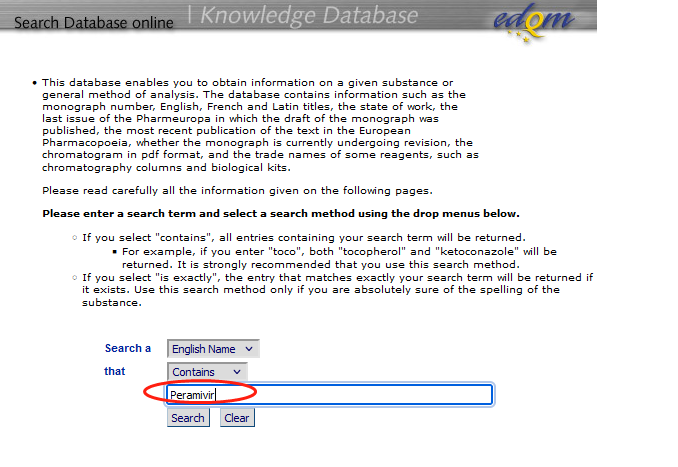
分析方法如果能直接引用药典则是最省事的。已说明每种C18色谱柱都不完全相同。药典方法无法重现的多数原因是没有正确选择色谱柱,EP和USP的个论中虽然没有提供色谱柱的品牌信息,但是在官网上提供了色谱柱的品牌信息。1、EP色谱柱检索链接https://www.edqm.eu/en/knowledge-database点击SearchKnowledge Databa

我们知道了FDA、EMA和PDMA,澳大利亚也有原研审评报告。那么澳大利亚的原研审评报告无法下载,以下是正确的打开方式:方法一澳大利亚官网https://www.tga.gov.au/选择下图红框菜单选择Industry » Prescription medicines »Regulatory decisions and notices进入以下界面,选择Australian Public Assess
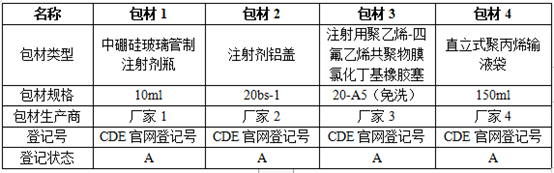
注射剂包装系统无质量风险是注射剂产品质量以及安全性合格的重要前提,那么这部分研究思路是怎样的,如何撰写申报资料以达到CDE审评要求呢?本文将对包装系统研究思路以及资料撰写思路进行讨论。包装系统研究主要有包装系统基本信息获取、包装系统的选择及匹配性、包材性能的对比以及包材相容性四个部分组成,由于篇幅有限本
给实验动物用药需要仔细考虑和计划,以优化给动物的药剂递送,同时最大限度地减少手术中的潜在不良反应。对于所有物种,都有许多不同的物质给药途径。必须考虑给药量、给药部位、物质的pH值和其他因素,以完善该技术。在研究的这一方面,训练不足或不注意细节可能会对实验动物产生无意的不良影响,并导致结果混乱。给实验动